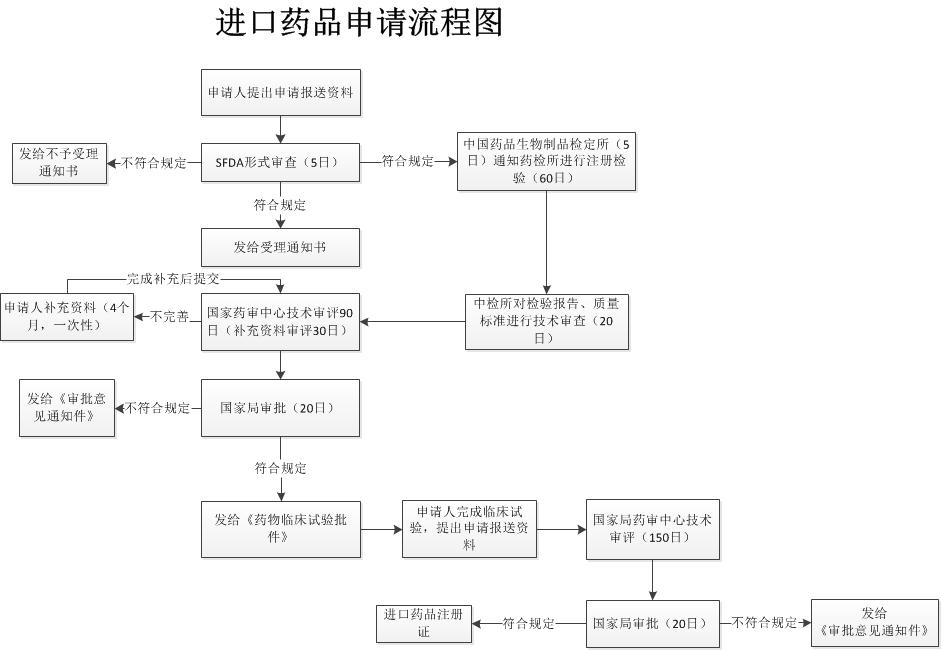
境外上市的药品申请在境内上市的申报流程图(注册分类5即进口药品注册申报流程图)
境外上市的药品申请在境内上市的申报资料目录(注册分类5即进口药品注册申报资料目录)
(一)概要
1.药品名称
2.证明性文件
3.立题目的与依据
4.药品说明书、起草说明及相关参考文献
5.包装、标签设计样稿
(二)药学部分
2.3.S主要研究信息汇总表(原料药)
3.2.S.1 基本信息
3.2.S.2 生产信息
3.2.S.3 特性鉴定
3.2.S.4 原料药的质量控制
3.2.S.5 对照品
3.2.S.6 包装材料和容器
3.2.S.7 稳定性
2.3.P主要研究信息汇总表(制剂)
3.2.P.1 剂型及产品组成
3.2.P.2 产品开发
3.2.P.3 生产
3.2.P.4 原辅料的控制
3.2.P.5 制剂的质量控制
3.2.P. 6 对照品
3.2.P.7 稳定性
(三)药理毒理部分
1.非临床研究概述及结果总结与评价
2.药理学试验资料及文献资料
3.非临床药代动力学试验资料及文献资料
4.非临床安全性试验资料及文献资料
(四)临床部分
1.临床试验计划及研究方案
2.临床研究者手册
3.知情同意书样稿、伦理委员会批准件;建议增加“科学委员会审查件报告”
4.临床试验综述
5.临床试验报告
6.药品说明书、起草说明及相关参考文献

境外上市的药品申请在境内上市的申报资料目录(注册分类5即进口药品注册申报资料目录)
(一)概要
1.药品名称
2.证明性文件
3.立题目的与依据
4.药品说明书、起草说明及相关参考文献
5.包装、标签设计样稿
(二)药学部分
2.3.S主要研究信息汇总表(原料药)
3.2.S.1 基本信息
3.2.S.2 生产信息
3.2.S.3 特性鉴定
3.2.S.4 原料药的质量控制
3.2.S.5 对照品
3.2.S.6 包装材料和容器
3.2.S.7 稳定性
2.3.P主要研究信息汇总表(制剂)
3.2.P.1 剂型及产品组成
3.2.P.2 产品开发
3.2.P.3 生产
3.2.P.4 原辅料的控制
3.2.P.5 制剂的质量控制
3.2.P. 6 对照品
3.2.P.7 稳定性
(三)药理毒理部分
1.非临床研究概述及结果总结与评价
2.药理学试验资料及文献资料
3.非临床药代动力学试验资料及文献资料
4.非临床安全性试验资料及文献资料
(四)临床部分
1.临床试验计划及研究方案
2.临床研究者手册
3.知情同意书样稿、伦理委员会批准件;建议增加“科学委员会审查件报告”
4.临床试验综述
5.临床试验报告
6.药品说明书、起草说明及相关参考文献

